LUYOR-3109高強度紫外催化光源促銷
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學透鏡,輸出紫外線強度高,...
2024-08-08作者:時間:2019-11-20 13:58:12瀏覽4254 次
基因編輯技術都是在細胞內利用外源切割復合體特異性識別并切割目的基因序列,在目的基因序列上制造斷裂端,這種斷裂端隨即會被細胞內部的DNA損傷修復系統修復,重新連接起來。在此修復過程中,當有修復模板存在時,細胞會以修復模板為標準進行修復,從而實現對基因序列的特異性改變,即基因編輯。
基因編輯技術
基因如何編輯
了解基因編輯的原理,首先要弄懂什么是基因。基因是具有遺傳效應的DNA(脫氧核糖核酸)片段,它能控制生物的性狀,支持生命的基本構造和性能。自DNA發現以來,科學家們一直在嘗試進行“基因編輯”,比如培育更高產的小麥、選育毛色更可愛的寵物……這些懵懂的“原始實驗”從未間斷。
基因編輯就是特異性地來改變目標基因序列的技術。如同對文本進行修改一樣,首先要把錯誤或想要修改的地方找出來,然后使用工具,按照修改的意圖,插入、刪除部分詞句或者改寫一段“文字”。當然,基因編輯是在細胞內對基因序列進行類似的操作,過程更加復雜:首先需要用一種復合體把目標基因序列特異性地識別出來,以避免“傷及無辜”;復合體再將DNA的雙鏈剪斷,在目標基因序列上制造斷裂端,這時細胞自身的DNA修復機制馬上會啟動,對斷裂端進行修復,讓它重新連接起來。如果在修復過程中,有一個“模板”存在,細胞就會以此為標準進行修復,基因編輯就此完成。
這種能切割的復合體必須是一把自帶“導航系統”的“剪刀”,即包含DNA識別區域和DNA切割區域。“剪刀”在基因編輯的過程中至關重要,因此找到更好用的“剪刀”一直是基因編輯的主要任務。
這把“剪刀”就是人工核酸酶。20世紀90年代,鋅指核酸酶(ZFNs)出現,該技術由鋅指蛋白實現對DNA的識別,由核酸酶進行精準切割。經過十幾年的發展,鋅指核酸酶技術已應用于果蠅、斑馬魚、大鼠、小鼠等多種模式動物的遺傳研究,成功實現了基因的修飾。2005年,它還實現了對人類細胞基因的定點修飾。然而,鋅指核酸酶的度要建立在龐大的鋅指表達文庫之上,從中篩選出鋅指蛋白,耗時費力,成本也高,因此沒有得到大規模的應用。
另一把“剪刀”是類轉錄激活因子核酸酶(TALENs),理論上它可以實現對任意基因序列的編輯,原理與鋅指核酸酶技術相似。雖然它在篩選、構建方面要容易一些,但同樣比較繁瑣,還可能引起機體免疫反應。魏文勝指出,雖然鋅指核酸酶、類轉錄激活因子核酸酶的使用門檻比較高,但是在一些領域如基因治療中,仍然有重要的價值。
CRISPR為何火
CRISPR是一個平民化的“神奇剪刀手”,更便宜、更便捷、靶向更加準確,讓基因編輯真正變得簡便好用的,是一把叫CRISPR的基因“剪刀”。細菌是在自然界分布最廣、個體數量最多的有機體。和大多數生物一樣,細菌也會受病毒感染,使其成為正常細菌的殺手——噬菌體。在漫長的進化過程中,細菌逐漸有了自己的應對之策——免疫系統。20世紀80年代末,研究人員在觀測大腸桿菌時發現,在細菌基因的尾端,有一些看上去很奇怪的重復序列。這些序列隨后被命名為成簇的規律間隔的短回文重復序列(CRISPR)。病毒性感染就像定時炸彈,在它“爆炸”之前,細菌只有很短的時間來處理,而CRISPR就是一個“拆彈專家”。
CRISPR是如何“拆彈”的?研究人員注意到,這些重復的序列之間總是由一些很古怪的間隔區(spacer)隔開,這些間隔區之所以看上去很古怪,是因為它們根本就不是細菌自身所有的東西,而是從噬菌體病毒的DNA上“剪”下來的小片段。簡言之,細菌細胞產生CRISPR相關蛋白(Cas蛋白),在病毒入侵之后,Cas蛋白便會結合到病毒DNA上,從上面“剪”下一塊病毒DNA,然后將其轉運到細菌細胞的基因組,插入其中,使之成為一處“間隔區”。從此以后,細菌細胞便會利用這一間隔區來識別與之相對應的病毒,實現對病毒再次入侵的免疫應答。更神奇的是,CRISPR系統還可以將獲得的部分DNA片段整合進基因組,形成記憶并遺傳,從而可以保護后代的細胞免受病毒的攻擊,就像隨身帶了一張基因的“疫苗接種卡”。
“科學家很快意識到,基于這種的靶向功能,CRISPR/Cas9系統可以被設計開發成一種的基因編輯工具,只要將被編輯的細胞基因組DNA看作病毒或外源DNA就可以了,從而使我們可以利用RNA(核糖核酸)來引導Cas9蛋白實現對多種細胞基因組的特定位點進行修飾。”黃志偉說。
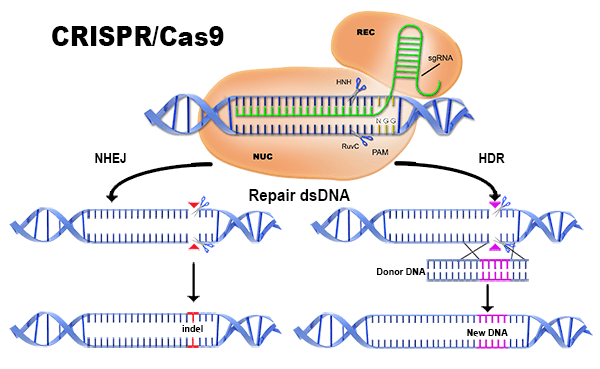
在CRISPR/Cas9技術中,基因編輯的實現需要這兩個工具——向導核糖核酸(gRNA)和Cas9蛋白,其中Cas9蛋白具有切割DNA片段的功能,可使DNA發生雙鏈斷裂,進而誘導細胞產生DNA 損傷修復。gRNA與Cas9蛋白結合在細胞中,會形成復合體,它會“檢索”細胞中所有的DNA,找到與其內部gRNA的序列相對應的位點,然后連接,讓Cas9蛋白質地把相關DNA“剪”掉,從而實現了對細胞中目標基因的編輯。“打個比方,CRISPR系統相當于一枚導彈,gRNA相當于它的引導部,而蛋白就相當于它的戰斗部。剪切不同基因的時候,只要改變gRNA的序列就可以了。”黃志偉說。
與鋅指核酸酶、類轉錄激活因子核酸酶技術相比,CRISPR技術顯得非常“平民化”,它無物種限制、成本低、易上手、實驗周期短、靶向更加準確,節省了大量的時間和成本。科學家希望用這種技術對人類的基因進行編輯,以達到治療疾病的目的,同時也希望將這種技術用到作物的改良之中。
“事實證明,CRISPR技術非常強大,因為它改寫的是底層的密碼。”魏文勝說。橫空出世的CRISPR/Cas9基因編輯技術被《科學》雜志評為2015年最重要的“突破性發現”,并被科學家認為是20世紀70年代以來最重要的基因工程技術。
基因編輯不能濫用
這一技術利器不能“為所欲為”,必須嚴格遵守相關原則和標準。大紅大紫的CRISPR技術把基因編輯帶到了“十字路口”。“首先是技術本身的問題。就CRISPR技術來說,雖然它很好用,但是基因‘剪刀’并不是越鋒利越好,既然它能夠‘中靶’,就同時存在‘脫靶’的可能,‘濫殺無辜’的情況不能完全避免。”魏文勝說。更讓科學家擔心的是,由于人類基因組也可以成為CRISPR的編輯對象,與此相關的倫理和安全準則相對滯后,可能帶來一系列的問題。比如“定制嬰兒”,如果對人類的胚胎進行編輯,一些來自父母的遺傳疾病可以被消除,父母缺乏的基因也可以被添加。
魏文勝認為,目前對一些技術的討論還僅僅停留在理論的層面上,比如定制一個“高智商”的嬰兒,影響人類智力的基因有很多,改變哪個基因或哪幾個基因會提高人的智力?這方面的知識尚不具備,而倫理問題也確實需要謹慎。我們應該更多地關注技術的監管和引導問題,把技術引導到良性發展的軌道上來。為此,美國科學院和美國醫學院成立了由全球22位學者組成的人類基因編輯研究委員會,就人類基因編輯的科學技術、倫理與監管開展了全面的研究,并于今年2月向全世界正式發布其研究報告。報告指出,人類基因編輯這一技術利器不能“為所欲為”,必須“按規矩行事”,嚴格遵守相關原則和標準。
對于體細胞基因編輯,報告提出4條原則:利用現有的監管體系來管理人類體細胞基因編輯研究和應用,限制其臨床試驗與治療在疾病與殘疾的診療與預防范圍內,從其應用的風險和益處來評價安全性與有效性,在應用前需要廣泛征求大眾意見。報告還提出,各國可以參照本研究的成果與建議,結合自身國情及現有法律,來制定人類基因編輯的管理條例,甚至立法。黃志偉說:“技術本身的前景非常好,下一步相關的法律和制度也要跟上,保證在一定的框架內讓基因編輯更好地服務于我們。”
“基因編輯技術如果使用不當,的確有可能造成一定的風險。”魏文勝表示,“但是從另一方面來看,正因為如此,才應該更多地去了解并掌握這項技術——我們對它的了解越多、越充分,才有更大的機會將它引導到正確的方向上來。”
基因編輯技術都是在細胞內利用外源切割復合體特異性識別并切割目的基因序列,在目的基因序列上制造斷裂端,這種斷裂端隨即會被細胞內部的DNA損傷修復系統修復,重新連接起來。在此修復過程中,當有修復模板存在時,細胞會以修復模板為標準進行修復,從而實現對基因序列的特異性改變,即基因編輯。