LUYOR-3109高強度紫外催化光源促銷
LUYOR-3109紫外光源采用了9顆365nm大功率led,安裝有二次光學透鏡,輸出紫外線強度高,...
2024-08-08作者:生命科學事業部時間:2019-10-07 14:06:51瀏覽5605 次
在無數科學家們的努力下,蟄居于水母內的水母蛋白及綠色熒光蛋白已經被導入病毒、放線菌、酵母、植物、果蠅、線蟲、小鼠、大鼠、人類細胞等幾乎所有的模式生物,為無數科學研究乃至人類重大疾病的研究做出了巨大的貢獻。熒光蛋白發出的生命之光,將繼續照亮生命科學領域未來的道路。
1. 熒光蛋白的研究歷史
2008年度諾貝爾化學獎授予美國科學家下村修(Osamu Shimomura)、馬丁.查非(Martin Chalfie)和錢永鍵(Roger Y. Tsien),以表彰他們在生物熒光方面所做的突出貢獻。下村修分離純化了水母素和綠色熒光蛋白。馬丁.查非展示了綠色熒光蛋白作為各種生物現象的亮光基因標簽的科研價值。而錢永鍵極大地方便了綠色熒光蛋白技術的應用,解釋了其機制,并發現了很多新的從紅到藍的顔色和相應的應用工具。
1962年,下村修和約翰森等在《細胞和比較生理學雜志》上報道了他們從水母(Aequorea victoria)中分離純化了發光蛋白水母素。第二年,他們在《科學》雜志上發表了鈣和水母素發光的關系的研究成果。Ridgway和Ashley利用水母素來檢測鈣濃度,同時水母素可以指示鈣的空間分布,目前該方法仍在延用。1974年,下村修和約翰森純化了綠色熒光蛋白(GFP)。Morin和Hastings發現水母素和GFP之間可以發生能量轉移,水母素在鈣刺激下發光,其能量可轉移到GFP并刺激GFP發光,即生物中發生的熒光共振能量轉移(FRET)現象。
1985年,普臘石和Satoshi Inouye根據水母素的蛋白質序列得到了水母素的基因序列,6年后拿到了GFP的基因序列。而GFP在其他生物體中的表達始于1994年,水母素也有相應重要的應用。水母素屬于熒光酶的一種,它的發光需要底物熒光素,鈣離子的存在可以促進發光反應的進行。而GFP蛋白質本身就可以發光。
GFP基因由3個外顯子組成,編碼形成一個由238個氨基酸殘基組成的單鏈多肽,分子量為27 KD。GFP的熒光發射峰位于509 nm,更大激發波長為395 nm,并于470 nm處有一肩峰。GFP通常以二聚體的形式存在,形成一個內含一個α-螺旋和外面包圍11個β-折疊鏈的β-桶狀結構。這些β-折疊彼此緊密結合,和α-螺旋組成一個單獨的致密結構域,沒有可供擴散的配體進入的縫隙,這種堅實的結構保證了其穩定性、抗熱性和抗變性劑等的特點,同時也說明了其生色基團只能自身環化,而非外源酶催化的原因。GFP的生色基團由位于第65-67位的3個氨基酸(Ser-Tyr-Gly)形成的對羥基苯咪唑啉酮構成,通過tyr66的脫質子狀態和質子化狀態的轉換來決定熒光發射。生色基團在藍光照射下,會吸收藍光的部分能量,進入脫質子狀態并發射出綠色熒光。
GFP具有眾多優點,由于其本身可以被光激發而發光,故其應用不需加任何底物,熒光性質穩定。GFP只有27 KD,相對分子量小,并對細胞沒有毒性。GFP沒有種屬特異性,沒有假陽性干擾,靈敏度高,易于檢測。GFP在生命科學領域的應用很廣泛,最常見的是作為報告基因構建基因工程載體。例如將目的基因與GFP基因連接后,可通過觀測融合蛋白的熒光特性來研究目的基因的表達和功能。如果將某種特定細胞利用GFP標記,就可以追蹤該種細胞的生長動態過程。同時,如果將某種病原體標記上GFP,通過觀察其在宿主內的運動方式和表達時間,可以研究該病原體與其宿主的關系。
錢永鍵于1994年開始研究GFP,他在下村修與查非的基礎上進一步闡明了GFP發光的化學機制,并通過改變其氨基酸排序,造出能吸收、發出不同顔色光的熒光蛋白,包括藍色、青色和黃色。其他研究人員又相繼從珊瑚和海葵等中克隆了光譜紅移的熒光蛋白基因。多色熒光蛋白技術使用科學家可以同時跟蹤幾種不同的生物過程,極大的促進了科學的發展。1995年,Heim等人將GFP上的Ser65點突變為Thr或Cys,熒光強度提高了4-6倍。此后的研究中用到的GFP突變體都是在此基礎上通過改變若干堿基得到的。但要注意的是,GFP具有緊密的蛋白結構,可以抵抗pH變化,溫度改變和變性劑的作用,而衍生的突變體多少會破壞其本身的結構,導致其對外界環境變化更加敏感。
以GFP為藍本通過基因技術合成的突變體發射光譜涵蓋了整個可見光波段,近幾年針對熒光蛋白的改造工作主要集中于提高熒光蛋白的亮度,改變Stokes位移(指激發峰與發射峰之間的距離)和光譜特性,以及尋找新型光轉換/光激活熒光蛋白等方面開展。下面介紹幾種較為常用的綠色/紅色熒光蛋白基因及發光特性。
mGFP5:將野生型GFP的ser65替換為thr,熒光強度較野生型的GFP提高了4-6倍。GFP的激發光波長與紫外線區較為接近,對光學要求較高,并且對生物有較大的毒害作用,不適宜作活細胞觀察。改造后的mGFP5的激發光波長提高到488 nm,位于青色區域,有效避免了上述缺點。目前這一突變體已被EGFP替換。
EGFP:在mGFP5的基礎上將Phe64替換為Leu,得到的GFP突變體命名為EGFP。EGFP的生色團在37℃的熒光得到了很大的提高,熒光強度較野生型GFP提高了35倍,并且在激發后16-24小時后仍可穩定地檢測到。當然,EGFP也有相應的缺陷,對pH較為敏感,易于二聚化。EGFP目前仍然是最常用的綠色熒光蛋白。
D2EGFP:在EGFP的C端加入422-461氨基酸殘基的小鼠鳥氨酸脫羧酶(MODC,mouse ornithine decarboxylase),得到一個不穩定的EGFP變體。MODC的422-461氨基酸殘基區包含一個PEST序列,靶定目的蛋白降解,d2EGFP只有2小時的半衰期。
多色GFP變體:將接近GFP生色團的Thr203突變為Trp后,可以將激發光和發射光的波長均增加20 nm,再進一步改造為黃色熒光蛋白EYFP。如果將GFP生色團中的Tyr66突變為His后得到藍色和青色熒光蛋白變體BFP/CFP。這些變體或存在光漂白現象,或熒光強度不高,或對pH變化敏感等缺陷,需要進一步的改進優化。
橙/紅色熒光(560-650 nm)可以較好的與共聚焦顯微鏡和寬視場顯微鏡兼容。橙/紅色熒光蛋白對于活體生物成像具有很好的應用前景,機體組織內的血紅素在可見光波段有強吸收,而水與脂肪在紅外波段有強吸收,在近紅外光波段(650-900 nm)的吸收系數最小且自發熒光最弱。此外基于其較長的激發光波長,對細胞毒性較小,可以用于檢測較深的組織。最早應用的橙色熒光蛋白是從一種熱帶珊瑚(Discosoma striata)中分離得到的,命名為DsRed。DsRed的激發光主峰值為558 nm,次要峰值為500 nm附近,熒光發射光波長為583 nm。DsRed成熟時間較長,易形成四聚體,阻礙了它的應用。
DsRed2:將DsRed的多肽氨基末端進行突變改造得到的熒光蛋白突變體DsRed2,減少了蛋白凝集作用,降低了細胞毒性,同時熒光蛋白的成熟時間也變短了。DsRed2依然會形成四聚體,由于成熟時間變短,在多色熒光實驗中可以更好地和GFP結合使用。DsRed2相對一代DsRed應用略廣泛。
DsRed-express:在DsRed2基礎上進一步改造得到的,成熟時間進一步變短,熒光強度也得到了增強。DsRed的紅色熒光要在表達后11小時才可以觀察到,DsRed2縮短為6小時,而DsRed-express則只要1小時。遺憾的是,DsRed-express的易聚集為四聚體問題仍未得到解決。
mRFP1:代單體紅色熒光蛋白mRFP1是通過改造DsRed的33個殘基而來,激發光波長為584 nm,發射光波長為607 nm。同其他熒光蛋白衍生物一樣,mRFP1也表現出明顯的熒光發射減弱和光漂白現象。
mCherry:通過對mRFP1的發色團殘基進行點突變獲得新的熒光蛋白,以相應的水果名字來命名為mCherry,發射峰位于610 nm。mCherry成熟快,單體特性好,光穩定性較強,但亮度偏低。
Kaede:從石珊瑚Lobophyllia hemprichii中克隆得到的,其在紫外光照射下,發射能從綠色(518 nm)變為紅色(580 nm)。Kaede是光轉換蛋白中的一種,具有一個能發出綠色熒光的由三肽His-Tyr-Gly發色團,它的熒光轉換是由于緊鄰發光團H62上的肽鍵發生斷裂而引起的。Kaede在斑馬魚中常用來作為研究細胞運動的標記基因,如標記原腸期的囊胚細胞研究匯聚延伸運動。Kaede易形成四聚體,限制了其在蛋白標記與超分辨成像方面的應用。
熒光蛋白的研究為生命科學提供了不可或缺的研究手段,目前在活體成像深度上仍有待進一步發展,需要不斷改良優化新的亮度高的單體近紅處/紅色熒光蛋白分子。新特性的熒光蛋白,如光轉換與光活化熒光蛋白、大strokes位移的熒光蛋白等的開發也將為光學成像技術帶來新的突破,有效地提高成像的時空分辨率和靈敏度。
蛋白標記的主要目的是監測生物過程、輔助檢測(例如化合物的可靠定量、蛋白質修飾的特異性檢測)或者純化標記后的蛋白及其結合對象。蛋白質的標記能夠提高檢測靈敏度以及簡化檢測工作流程。
目前有多種蛋白質標記技術來幫助我們研究感興趣的蛋白質的豐度、位置、相互作用、翻譯后修飾、功能,乃至監測活細胞中的蛋白質運輸等問題。目前有多種類型的標記物和標記方式可供選擇,但是針對特定的應用應當選擇適合的標記策略。
no.1 代謝標記策略
代謝標記策略是一種體內標記方法,在這種方法中,細胞被“喂養”了化學標記的營養物,然后這些標記物被摻入新合成的蛋白質、核酸或代謝物中。然后,我們可以收集細胞并分離這些分子以獲得細胞生物過程的全局視圖。
蛋白同位素標記
原理:蛋白同位素標記是一種經典的蛋白示蹤和蛋白組學定量技術,用天然同位素(輕型)或穩定同位素(重型)標記的必需氨基酸取代細胞培養基中相應氨基酸,這樣細胞新合成的蛋白質可以在細胞生長期間通過摻入含有不同同位素的氨基酸進行標記。
應用舉例:蛋白質組學研究方向流行的代謝標記方法是SILAC(Stable Isotope Labeling with Amino acids in Cell culture),即細胞培養中氨基酸的穩定同位素標記。結合質譜技術,SILAC通過使用重型氨基酸(例如,15N-或13C-賴氨酸)標記其中一組培養物或細胞系,而向另一組添加正常的輕型氨基酸,從而量化兩種培養物或細胞系之間蛋白質豐度的差異。然后將在這兩種條件下生長的細胞的裂解蛋白按細胞數或蛋白量等比例混合,經分離、純化后進行質譜鑒定,根據一級質譜圖中兩個同位素型肽段的面積比較進行相對定量,得到兩種條件下蛋白質豐度差異的相對評估。

圖1 SILAC的工作流程
其他蛋白質代謝標記物
原理:如果不具備質譜實驗條件,那么可以使用基于生物正交反應的代謝標記方法。在生物正交系統中,細胞被“喂食”標記有一些對天然生物反應基團無反應的化學基團的分子結構單元。添加含有該基團的反應配偶體的外源性化合物引發化學反應,將標記的生物分子偶聯至所需的官能團。
應用舉例:用含有疊氮基團的結構單元“喂養”細胞,然后在實驗后用含有磷化H基團的試劑進行處理,疊氮化物和-PH2基團通過Staudinger連接反應偶聯,疊氮化物和膦基團通常不存在于生物系統中,因此這些分子是惰性的。

圖2 Staudinger連接反應
no.2 熒光標記策略
自發熒光蛋白、小分子熒光標志物染料、納米晶體材料(即量子點材料)、小分子蛋白質標簽等等這些材料都可以作為熒光標志物,結合熒光成像檢測儀器可以對目標蛋白的表達情況、細胞中的定位情況、相互作用、活性狀態等指標進行研究。
熒光蛋白標簽
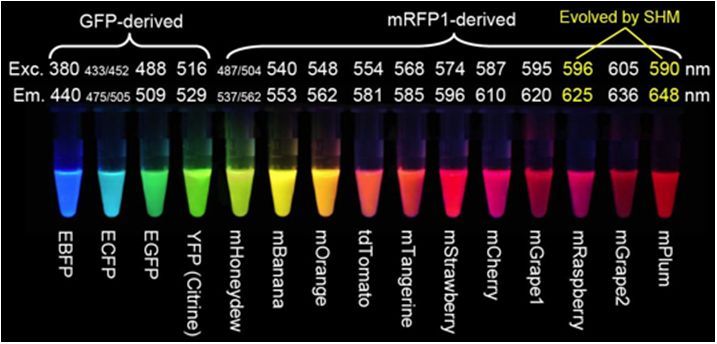
若將目的蛋白與熒光蛋白融合,則能夠實現目的蛋白的細胞內觀察,可用于多色標記和熒光共振能量轉移(FRET)應用,用于可視化蛋白質與其他亞細胞結構的易位,研究蛋白質-蛋白質共定位,檢測來自不同啟動子的基因表達的開始,以及混合細胞群的分離。從早期的綠色熒光蛋白GFP發展到現在,我們已經擁有了覆蓋多種光譜區域的熒光蛋白,包括綠色熒光蛋白、藍色和藍綠色熒光蛋白、黃色熒光蛋白、橙色熒光蛋白、紅色熒光蛋白,不同光譜型的熒光蛋白在亮度、光穩定性、分子大小上有所不同。
圖3 熒光蛋白標簽
熒光染料蛋白體外標記
熒光染料標記蛋白或多肽技術是常見的蛋白體外標記技術,除了GFP等融合表達熒光蛋白之外,目標蛋白經過熒光染料標記可以直接進行活體示蹤、細胞分選等下游實驗操作。
原理:熒光標記所依賴的化合物稱為熒光物質。熒光物質是指具有共軛雙鍵體系化學結構的化合物,受到紫外光或藍紫光照射時,可激發成為激發態,當從激發態恢復基態時,發出熒光。蛋白熒光標記技術利用熒光物質共價結合在目標分子的某個基團上,利用它的熒光特性來提供被研究對象的信息。
應用和特點:活化的熒光染料,例如FITC、7-氨基-4-甲基香豆素(AMC)、羅丹明B(Rhodamine B)或Alexa Fluor染料等,可用于標記抗體或蛋白功能基團,生成分子探針并通過熒光成像進行檢測。當用熒光染料化學標記特異性抗體或其他純化的生物分子時,它們成為用于檢測靶抗原或相互作用配偶體的熒光探針,應用于細胞成像、流式細胞術、蛋白質印跡和酶聯免疫吸附實驗(ELISA)。因為熒光標記物具有無放射物污染、操作簡便等優點,使其在蛋白功能研究、藥物篩選等許多研究領域的應用日趨廣泛。

圖4 四種常見的熒光染料
蛋白量子點標記
原理:量子點(Quantum Dots)是一種無機納米結晶體,它可以根據其大小發出特定波長的熒光,它具有非常高的消光系數,其消光系數要比小分子熒光基團和熒光蛋白高出10~100倍,同時量子點的量子產率也很好。典型的量子點都含有一個CdSe或CdTe核心,外面包裹一硫化鋅(ZnS)外殼。量子點的吸收波長范圍覆蓋從非常短的波長至略低于其發射波長的廣闊范圍,因此一束單波長激發光就可以讓量子點達到多重發射。
應用和特點:目前研究出的水溶性量子點和油溶性量子點可以與抗體、鏈霉親和素等分子進行偶聯,應用于生物標記檢測、高通量編碼、活體成像及動態示蹤等領域。不過結合了生物大分子的水溶性量子點體積較大(直徑約10 nm~30 nm),從而阻礙了它通過細胞膜結構,因此只能用于經過透化處理的細胞,或者只能對胞外蛋白或可以被細胞內吞的蛋白進行研究。

圖5 量子點與麥芽糖結合蛋白(MBP)大小比較。每個直徑為6 nm的量子點可附著約15~20個MBP分子。
no.3 其他標記策略
生物素標記
原理:生物素(Biotin)是蛋白質檢測、純化和固定的有用標簽,因為它可以高親和力地與鏈霉親和素(Avidin)和鏈霉親和素(Streptavidin,SA)結合。生物素-親和素的親和力至少比抗原-抗體結合力高百萬倍,這種相互作用是蛋白質和配體之間最強的非共價相互作用之一。另外,生物素(MW = 244.3 Da)比酶標記物小得多,因此不太影響蛋白質本身的天然功能。總之,這些特征使得生物素-親和素策略成為許多檢測和固定應用的理想選擇。
生物素化蛋白質是生物素與蛋白質共價結合的產物,因為生物素化蛋白質同時具備了高親和力、高特異性和高靈敏度的優點,所以它提高了基于免疫方法的檢測、純化蛋白質技術的效率。
應用:生物素-親和素系統廣泛用于流式細胞術、熒光成像、蛋白質印跡和ELISA檢測,以增加信號輸出和更高的靈敏度。親和素或鏈霉親和素的熒光綴合物用于檢測生物素化的生物分子。親和素或鏈霉親和素的酶綴合物,通常用于蛋白質印跡,ELISA和原位雜交成像應用。親和素或鏈霉親和素綴合的磁珠和樹脂可用于分離蛋白質、細胞和DNA,也可用于免疫分析或生物篩檢。

圖6 蛋白質生物素化
酶蛋白偶聯物
以辣根過氧化物酶(HRP)和堿性磷脂酶(AP)為代表的酶標記物適用于與蛋白偶聯并為免疫檢測制備抗體偶聯物。這兩種標記物常被用于標記抗體后用作ELISA檢測。
HRP適用于快速顯色反應,ELISA檢測中加入底物后在5~10 min內即可到達OD450值1.8~2.5左右,而AP適用于慢速顯色反應,其顯色時間約4~8 h,催化形成的黃色化合物比較穩定,比較適合酶促動力學的定量檢測。
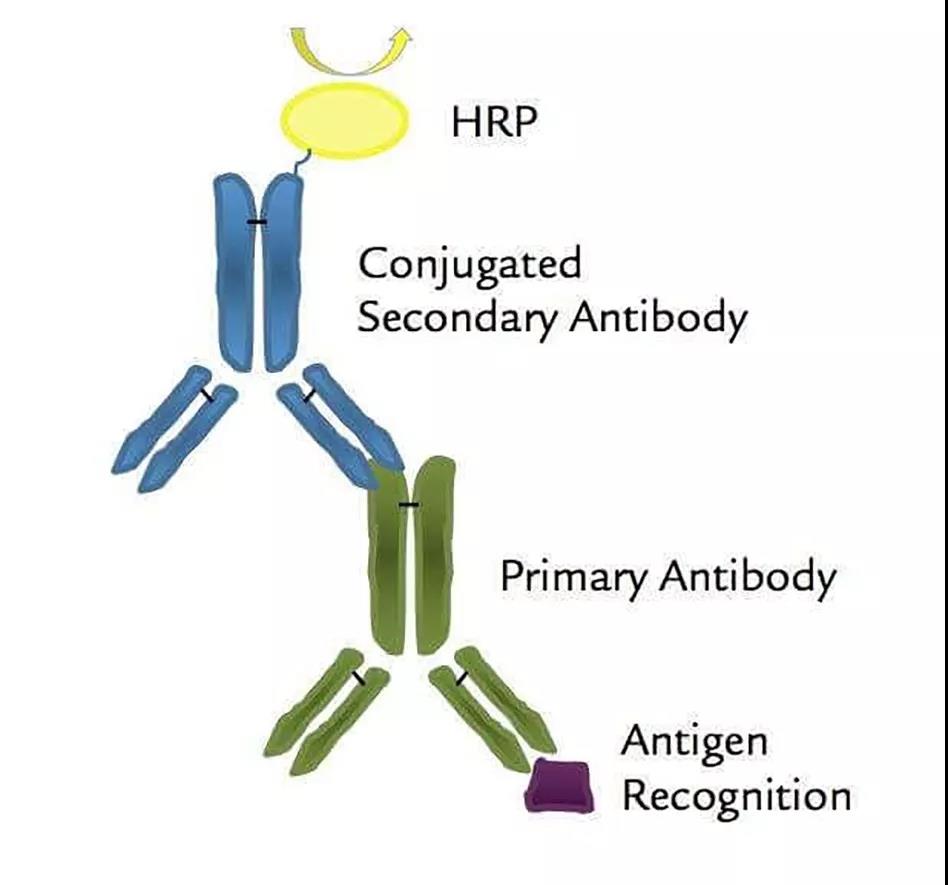
圖7 HRP/抗體綴合